Закон Фарадея: Формула та її значення у електрохімії
Закон Фарадея формула є однією із ключових основ електрохімії та відіграє важливу роль у розумінні процесів, що відбуваються в електрохімічних комірках. Цей закон був сформульований Майклом Фарадеєм у XIX столітті, і він залишається фундаментальним принципом у галузі науки про електричні процеси в електролітах.
Історична перспектива
Майкл Фарадей був одним з найбільш видатних вчених свого часу, і його вклад у фізику та хімію є безцінним. У 1833 році Фарадей сформулював свої закони електролізу, які описують кількість речовини, що вивільняється або поглинається під час проходження електричного струму через електроліт.
Основи Закону Фарадея
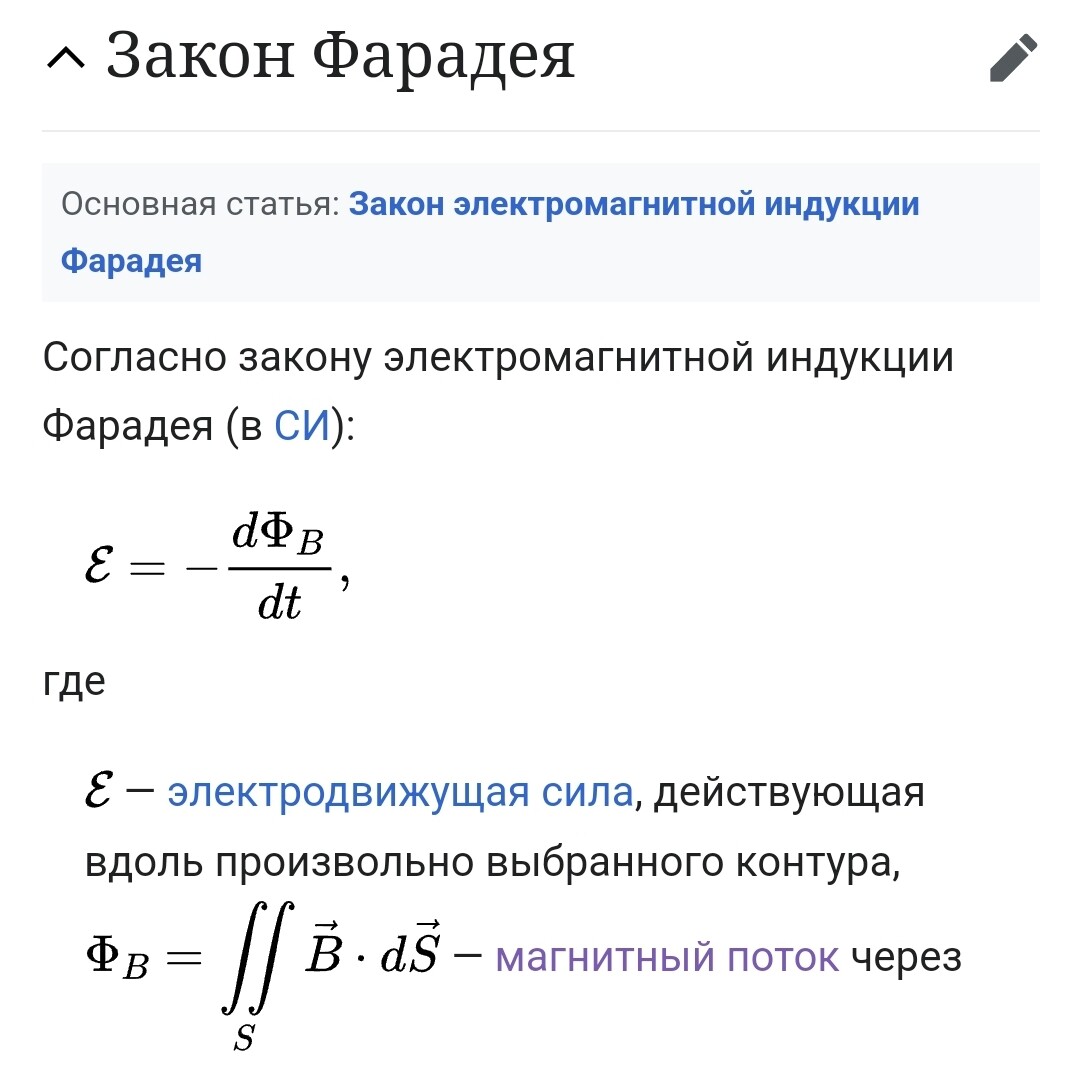
Закон Фарадея формула виражається в двох основних законах електролізу, які можна сформулювати так:
- **Перший закон Фарадея**: Кількість речовини, що вивільняється на електроді під час електролізу, прямо пропорційна кількості електричного заряду, що проходить через електроліт.
- **Другий закон Фарадея**: Кількість різних речовин, що виділяються або поглинаються при проходженні однієї і тієї ж кількості електричного заряду, прямо пропорційна їх еквівалентним масам.
Формула Закону Фарадея
Фарадей вивів формулу, яка є аналітичною базою для обчислення маси речовини, виділеної або поглиненої на електроді:
m = (Q × M) / (n × F)
Де:
| Символ | Означення |
|---|---|
| m | Маса речовини (у грамах) |
| Q | Кількість електричного заряду (у кулонах) |
| M | Молярна маса речовини (у г/моль) |
| n | Кількість електронів, необхідних для реакції |
| F | Число Фарадея, рівне приблизно 96485 Кл/моль |
Практичне застосування Закону Фарадея
Закон Фарадея широко використовується у різних галузях, включаючи:
- Виробництво металів: у процесах, таких як електролітичне очищення та гальванічне осадження металів.
- Аналіз та очищення води: у технологіях, пов’язаних з електролізом для знезараження води.
- Хімічний синтез: у електросинтезі різних хімічних сполук.
Розуміння закону Фарадея та його формул є ключовим для наукових досліджень і промислових процесів, що використовують електрохімічні реакції. Цей закон не лише пояснює поведінку електролітів, але і дає точні інструменти для кількісного аналізу процесів електролізу.
Висновки
Закон Фарадея, формула якого описує взаємозв’язок між електричним зарядом та кількістю речовини, є невід’ємною частиною сучасної електрохімії. Вивчення цього закону відкриває широкі можливості не лише для наукових досліджень, але й для практичних застосувань у промисловості.
Зателефонуючи до цього закону уможливлює розробку й вдосконалення технологій, які впливають на наше повсякденне життя, від захисту навколишнього середовища до створення нових матеріалів і джерел енергії.