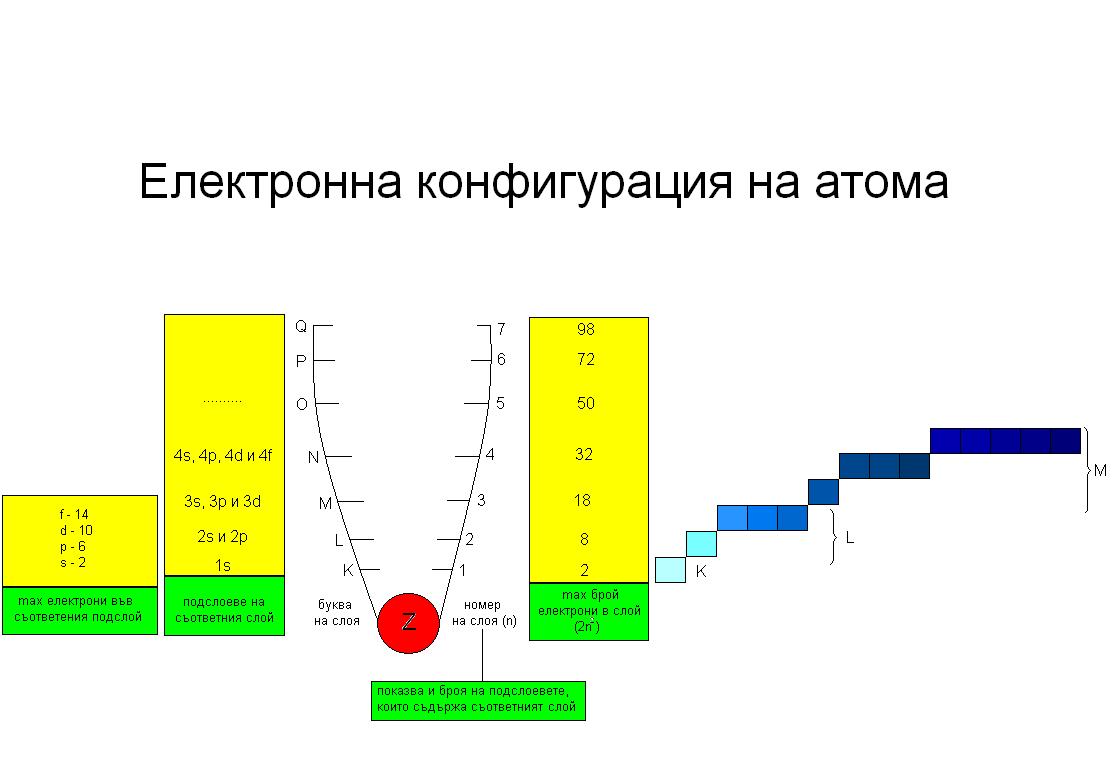
Що таке електронна формула?
Електронна формула — це метод опису розподілу електронів у атомі по енергетичним рівням та підрівням. В основі цього концепту лежать квантово-механічні принципи, які визначають положення електрона в атомній оболонці. Електронні конфігурації атомів є критично важливими для розуміння хімічних властивостей елементів та їх здатності до хімічних реакцій.
Основи електронної конфігурації
Щоб зрозуміти, як створюється електронна формула, важливо розібратися з основними поняттями квантової механіки, такими як квантові числа і принципи заповнення атомних орбіталей.
Квантові числа
Кожен електрон в атомі характеризується чотирма квантовими числами:
- Головне квантове число (n): визначає енергетичний рівень електрона.
- Орбітальне квантове число (l): визначає форму орбіталі.
- Магнітне квантове число (m): визначає орієнтацію орбіталі в просторі.
- Спінове квантове число (s): характеризує напрямок спіну електрона.
Принципи заповнення орбіталей
- Принцип Паулі: жодні два електрони в атомі не можуть мати однакові чотири квантові числа.
- Принцип минимізації енергії: електрони заповнюють орбіталі у порядку зростання їх енергії.
- Правило Гунда: при заповненні підрівня електрони займають орбіталі таким чином, щоб максимізувати спін.
Оформлення електронної формули
Тепер, знаючи основи квантової механіки, можна перейти до складання електронної формули. Це робиться через опис розподілу електронів по енергетичних рівнях та підрівнях.
- Вказують номер енергетичного рівня (n).
- Записують тип орбіталі (s, p, d, f).
- Вказують кількість електронів в цій орбіталі. Наприклад, для вуглецю, 1s22s22p2.
Цей підхід дозволяє чітко і наочно відображати внутрішню будову атома.
Приклад електронної конфігурації
| Елемент | Електронна формула |
|---|---|
| Гідроген | 1s1 |
| Гелій | 1s2 |
| Карбон | 1s2 2s2 2p2 |
Значення електронної конфігурації
Електронна формула не тільки визначає структуру атома, але й пояснює багато фундаментальних хімічних властивостей. Наприклад, валентність, реакційна здатність, поява іонів тощо.
Вплив на хімічну активність
Елементи з незаповненими зовнішніми орбіталями, як правило, є більш хімічно активними. Це тому, що вони прагнуть до стабільності через обмін або прийом електронів.
Розуміння періодичної системи
Періодична система елементів організована на основі повторюваних закономірностей у електронних конфігураціях. Це дозволяє нам передбачити поведінку елементів і їх хімічні властивості, відштовхуючись від їх положення у системі.
Електронна формула є основою сучасної хімії, що допомагає зрозуміти, як саме поведуть себе атоми у взаємодії один з одним, і яка буде результативність таких реакцій. Завдяки цьому розумінню, ми можемо передбачати і досліджувати нові матеріали і проводити інновації в багатьох галузях науки і техніки.