Формула сульфатної кислоти: структура та властивості
Формула сульфатної кислоти — H2SO4, відома ще з давніх часів, є однією з найбільш важливих та широко використовуваних сполук у хімії. З погляду хімічної індустрії, сульфатна кислота є ключовим компонентом багатьох виробничих процесів та наукових досліджень.
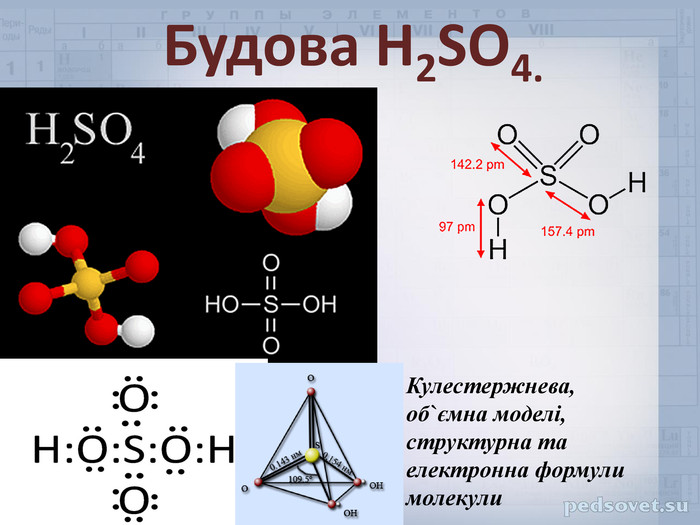
Будова молекули сульфатної кислоти
Основою для розуміння властивостей сульфатної кислоти є її структура. Молекула H2SO4 складається з двох атомів водню (H), одного атома сірки (S) та чотирьох атомів кисню (O).
| Елемент | Кількість атомів |
|---|---|
| Водень (H) | 2 |
| Сірка (S) | 1 |
| Кисень (O) | 4 |
Сірка в окисленні +6 утворює чотири ковалентні зв’язки з атомами кисню. Два з цих зв’язків є подвійними, а ще два – з’єднані через гідроксильні (-OH) групи, що надають кислотні властивості.
Фізичні властивості
Сульфатна кислота, зазвичай безбарвна, є дуже гігроскопічною рідиною. Це означає, що вона здатна поглинати вологу з навколишнього середовища. Концентрована сульфатна кислота має високу щільність і є сильно корозійною. Вона має високу температуру кипіння, що робить її стійкою до випаровування при стандартних температурних умовах.
- Густина: приблизно 1.84 г/см3
- Температура плавлення: 10.37°C
- Температура кипіння: 337°C
Хімічні властивості
Хімічна активність сульфатної кислоти обумовлена її високим ступенем електролітного дисоціації, що робить її сильною кислотою.
Взаємодія з металами
Концентрована сульфатна кислота активно реагує з багатьма металами, утворюючи відповідні сульфати та виділяючи водень. Наприклад:
- Fe + H2SO4 → FeSO4 + H2↑
- Cu + 2H2SO4 (конц.) → CuSO4 + 2H2O + SO2↑
Важливо зазначити, що з деякими металами реакції можуть протікати тільки при нагріванні або в умовах концентрованої кислоти.
Взаємодія з оксидами та гідроксидами
Сульфатна кислота також вступає в реакції нейтралізації з основними оксидами та гідроксидами, утворюючи сульфати металів та воду:
- CaO + H2SO4 → CaSO4 + H2O
- NaOH + H2SO4 → NaHSO4 + H2O
Застосування сульфатної кислоти
Завдяки своїм виразним хімічним властивостям, сульфатна кислота знайшла широке застосування у багатьох галузях. Вона використовується у виробництві добрив, очищенні металів, органічному синтезі, нафтохімічній промисловості та навіть у виробництві вибухових речовин. Сульфатна кислота є також невід’ємною частиною багатьох лабораторних процесів, як у аналітичній, так і у синтетичній хімії.
Формула сульфатної кислоти не лише символизує її хімічну структуру, але й відкриває безліч методів її застосування, що робить цю сполуку важливою частиною сучасної науки і техніки.